遺伝子研究を実施する過程で、例えば、小さな解剖学的口腔腫瘍、単一細胞サンプル、およびヒト細胞で非常に低いレベルで転写される特定の遺伝子変異のサンプルを研究するための不十分な RNA サンプルに遭遇することがよくあります。もちろん、COVID-19 テストでは、綿棒が適切な場所になかったり、サンプリング中に十分な回数がなかったりすると、サンプル サイズが非常に少なくなります。検査に合格し、核酸サンプラーが 6 回のサンプルを採取しなかった場合は、それを報告できます。
あれこれ問題があるので試薬の感度は重要ですが、RT-PCR の感度を上げるにはどうしたらよいでしょうか?
考えられる解決策について説明する前に、今述べた状況に伴う 2 つの大きな問題について触れておきます。
まず第一に、サンプルに含まれる細胞集団が少ない場合、RNA の損失が心配です。カラム法や核酸沈殿法などの従来の分離・洗浄法では、わずかなサンプルが失われる可能性が高くなります。1 つの解決策は、tRNA などのキャリア分子を追加することですが、それでも回復実験が問題ないという保証はありません。
では、より良い方法は何ですか?培養細胞または微小解剖学的サンプルの適切なオプションは、直接溶解を使用することです。
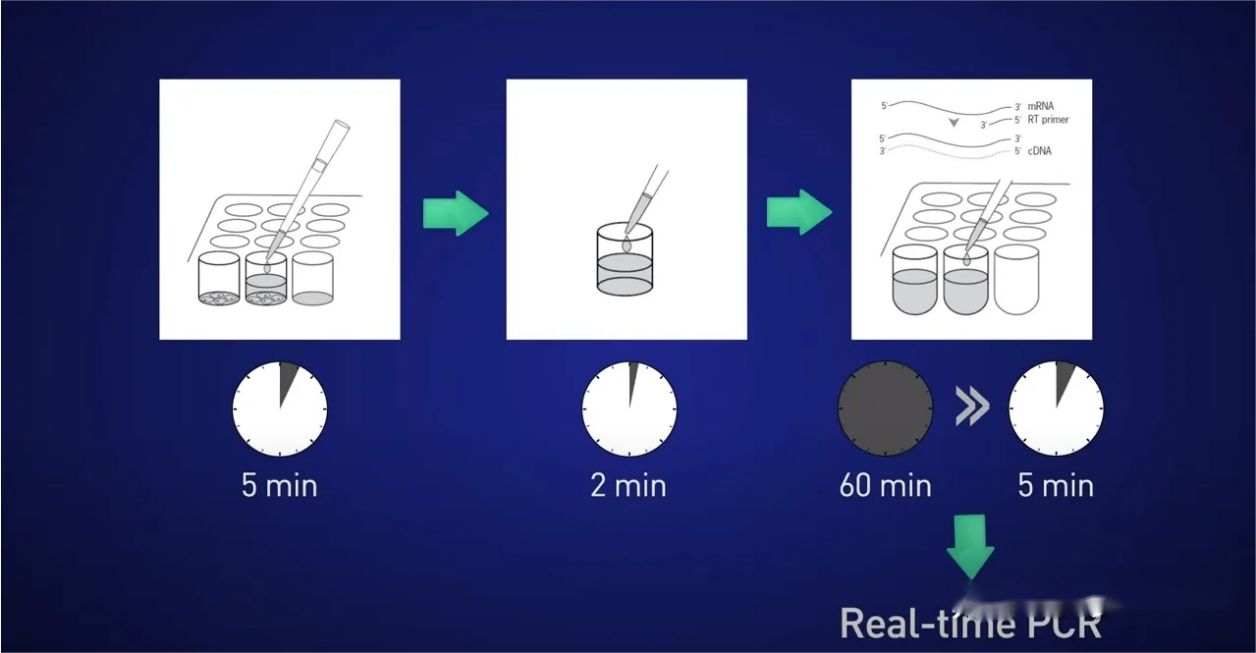
アイデアは、細胞を 5 分間分割し、RNA を溶液に放出し、その後 2 分間反応を停止し、RNA が失われないようにライセートを逆転写反応に直接加え、最終的に得られた cDNA を直接入れることです。リアルタイムの反応に。
しかし、出発点が限られているか、標的遺伝子の発現量が少ないために、すべての RNA をリサイクルできても、リアルタイムで良好なシグナルを得るのに十分なテンプレートを提供できない場合はどうなるでしょうか?
この場合、前増幅ステップは非常に役立ちます。
以下は、逆転写後の感度を上げるためのスキームです。開始する前に、どのターゲットに関心があるかをダウンストリームに問い合わせて、事前増幅用のこれらのターゲットに固有のプライマーを設計する必要があります。
これは、最大 100 ペアのプライマーと 10 ~ 14 回の反応サイクルで混合プライマーを作成することによって実現できます。したがって、得られたcDNAを事前に増幅するには、この要件に合わせて特別に設計されたマスターミックスが必要です。
サイクル数を 10 ~ 14 に設定する理由は、この限られたサイクル数によってさまざまなターゲット間のランダム性が保証されるためです。これは、定量的な分子情報を必要とする研究者にとって重要です。
前増幅の後、大量のcDNAを取得できるため、バックエンドでの検出感度が大幅に向上し、サンプルを希釈して複数のリアルタイムPCR反応を実行して、ランダムエラーの可能性を排除することもできます.
投稿時間: 2023 年 4 月 11 日